Christian Honoré, forskare inom cellbiologi vid Novo Nordisk anläggning i Målöv utanför Köpenhamn.

Jacob Sten Petersen är corporate vice president och forskningsansvarig för diabetes- och stamcellsområdet på danska läkemedelsjätten Novo Nordisk, en av världsspelarna inom diabetesvård. Han konstaterar att cellterapi som forskningsfält växer mycket snabbt nu.

– Antalet kliniska studier har ökat på senare år. Tekniken har utvecklats enormt och nu kan man i princip ta en stamcell och få den att mogna fram till många olika celltyper. Då finns det chans att behandla Parkinsons sjukdom, ögonsjukdomar, ryggmärgsskador, diabetes, stroke och en rad andra allvarliga kroniska sjukdomar. Frågar du mig har vi bara sett toppen på isberget. Läkemedelsindustrin kommer lägga stora pengar på detta de närmaste decennierna, säger Jacob Sten Petersen.
Kristina Kannisto, projektledare vid Karolinska Centrum för Cellterapi, ser samma sak. Hon är på deltid projektledare för Konkurrenskraft inom cell- och genterapi, som drivs av innovationsprogrammet Swelife med finansiering från Vinnova. Projektets mål är att samla och sprida kunskap för att svenska företag, myndigheter och organisationer ska kunna arbeta med cell- och genterapier.

– Nu satsas det mycket på svåra sjukdomar som saknar adekvat behandling, för där är behovet störst. Men jag tror att det här fältet med tiden kommer att täcka in de flesta sjukdomar. Det handlar ju om att återuppbygga oss själva med kroppens egna byggstenar, därför ser jag inga begränsningar för användningsområdet, säger Kristina Kannisto.
Svårt att säkra jämn kvalitet
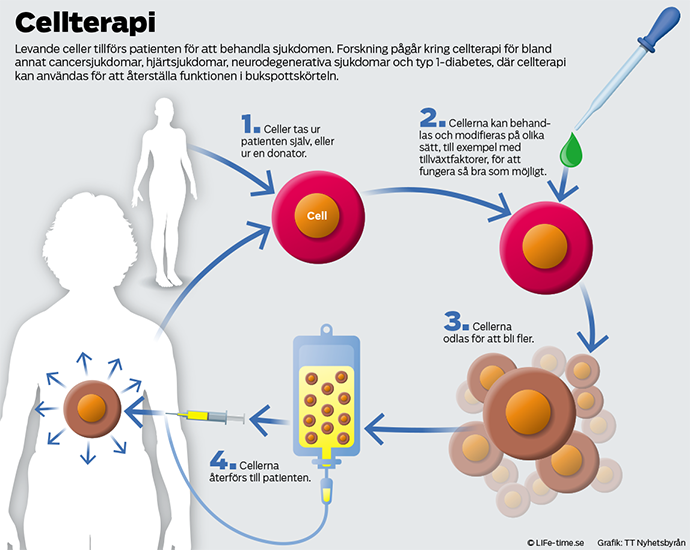
Vid cellterapi behandlas patienter med levande celler för att byta ut eller reparera skadad vävnad, eller behandla exempelvis cancer eller diabetes. Det finns många olika metoder – från transplantation av mogna eller delvis mogna celler, till bearbetning och styrning av stamceller – och flera möjliga källor att hämta cellerna från.
De kan utvinnas ur en annan person, vilket man gör vid så kallad allogen stamcellstransplantation. Då ges blodbildande celler av en frisk donator till en patient som genomgår cancerbehandling. Celler kan också utvinnas ur den egna kroppen, autolog transplantation, eller tas från donerade embryon som blivit över efter IVF-behandlingar.
– Den stora vetenskapliga utmaningen ligger i att celler är en så heterogen produkt, rent farmakologiskt. Hur tar vi fram test- och produktionsmetoder som säkrar att vi får fram samma celler, med samma effekt, till varje ny injektion? En del kunskap kan vi få från produktionen av biologiska läkemedel. Men där utvinner man läkemedel ur en cell, medan vi istället vill använda hela cellen, säger Jacob Sten Petersen.
Ökat samarbete med vården krävs
Kristina Kannisto konstaterar att cellterapi kommer att ställa helt nya krav på läkemedelsföretag och vårdpersonal. När den färdiga produkten i praktiken består av mänsklig vävnad, kommer vården behöva vara mer involverad än när traditionella läkemedel används.
– Här kan inte företagen köra ett eget race. Det här är inga produkter som någonsin kommer att säljas på apotek. Celler och vävnader behöver bearbetas i komplexa processer, kanske på ett företag – men först måste materialet tas tillvara i vården, och sedan också återföras i samarbete med vården, säger Kristina Kannisto.
Hon får medhåll av Pontus Blomberg, verksamhetschef för Karolinska Centrum för Cellterapi vid Karolinska universitetssjukhuset och en av initiativtagarna till CAMP, Center for Advanced Medical Products, en satsning av Vetenskapsrådet och Vinnova på samarbeten inom cell- och genterapi.
– Det finns ett gemensamt intresse från akademi, industri och vård att få fram de här behandlingarna, och ingen kan dra hela lasset själv. I Sverige har vi bra förutsättningar: vi har bra forskning inom cellterapi, bra sjukvård och industri som varit framgångsrik – men vi har saknat den sammanhållande funktionen. Det är den vi vill åstadkomma med CAMP, säger Pontus Blomberg.
Genom att knyta samman många olika aktörer ska centret identifiera utmaningar och söka gemensamma lösningar. Ett exempel är logistiken kring cellprodukterna. Hur gör man med en produkt som måste tillverkas och ges färsk, om tillverkningen finns på ett ställe och patienten på ett annat?
Omoget regelverk
Kristina Kannisto lyfter också fram komplicerade och föränderliga regelverk. Behandlingar som tidigare klassats som transplantationer och därmed övervakats av Socialstyrelsen och Inspektionen för vård och omsorg, omklassas i många fall till läkemedel som regleras av annan lagstiftning. Det ställer andra krav på bland annat tillverkning, krav som vården inte alltid hunnit anpassa sig till och inte har någon erfarenhet av. Enligt Kristina Kannisto har övergången mellan de två systemen inte alltid varit så lätt. Ibland har olika instanser gett forskare och vårdpersonal motstridiga besked.
– Det är därför Karolinska har startat ett centrum för cellterapi. Det behövs en stödfunktion, någon man kan ringa till för att få hjälp med planering av behandling, forskningsprojekt, ansökningar till Läkemedelsverket och annat.
Även Jacob Sten Petersen betonar att mycket arbete återstår kring reglering och säkerhet.
– Det regulatoriska området är väldigt omoget ännu. Hur genomför man kliniska studier, vad ska man ha för endpoints och hur hanterar man riskerna? Tidigt i en stamcells utveckling är den pluripotent. Den kan utvecklas till vad som helst och kan potentiellt förvandlas till en cancercell. Hur kontrollerar man det? Vid mycket svåra och livshotande sjukdomar finns en viss tolerans för risker, men om vi till exempel ska behandla barn med typ 1-diabetes, som redan har en välfungerande terapi, så är situationen annorlunda. Då blir säkerhetskraven mycket höga, säger Jacob Sten Petersen.
När cellterapier börjar komma ut på marknaden kommer det att kullkasta många av dagens sätt att sälja och betala ut ersättning.
Nya affärsmodeller blir nödvändigt
– Traditionellt har läkemedelsföretag sålt genom att kontakta läkare och förklara hur mycket bättre ens produkt är jämfört med konkurrenternas. Hela den affärsmodellen kommer att behöva förändras. Men exakt hur de nya modellerna ska se ut är för tidigt att säga. Vi vet till exempel inte hur effektiva cellterapierna kommer vara, om det kommer räcka med en behandling eller behövas flera. När vi vet mer om det, kommer affärs- och ersättningsmodeller ta form, säger Jacob Sten Petersen.
Han påpekar att det också kommer spela roll för prissättningen att många processer som är del av behandlingen kommer att behöva utföras av sjukvården, inte av företagen. Pontus Blomberg konstaterar samma sak: de nya behandlingarna måste ges på platser med specialkompetens, kanske separata enheter inom sjukhusen. Då kommer vården till en början behöva ökade resurser för kompetensutveckling, och kanske för att öka antalet intensivvårdsplatser som står redo vid eventuella svåra biverkningar. Men på sikt kan kostnaden vändas till vinst.
Cellterapier snart på bred front
– Om behandlingen blir så effektiv att patienten kan lämna sjukhuset efter några dagar, botad, så får man ju mycket kortare vårdtider. Det blir en enorm kostnadsbesparing för både vården och samhället. Men till en början blir det här dyra terapier som kan vara svåra att hantera hälsoekonomiskt – särskilt när man inte vet om behandlingen kommer att vara verksam i tre eller trettio år, säger Pontus Blomberg.
Vi ser väldigt lovande resultat från kliniska studie kring flera sjukdomar. Det närmaste decenniet är cellterapi ready for prime time.
En möjlighet han ser är att läkemedelsbolagen erbjuder garantier, så att betalaren får pengarna tillbaka om behandlingen inte fungerar. Eller att behandlingen betalas varje år den har effekt. Trots utmaningarna är Jacob Sten Petersen övertygad om att cellterapier kommer på bred front de kommande årtiondena.
– Vi ser väldigt lovande resultat från kliniska studier kring flera sjukdomar. Det närmaste decenniet är cellterapi ready for prime time. Men sedan kommer behandlingarna fortsätta att förbättras under många år. Precis som att diabetesbehandlingar har gått igenom en mängd utvecklingssteg genom decennierna, så kommer cellterapier att göra det. Först har de en viss effekt, sedan kan vi förfina dem när vi lär vi oss mer. Men "genombrottet" i laboratoriet, det har vi egentligen redan haft.
– Nu behöver industrin bara omsätta de lovande resultaten i något som hjälper människor med allvarliga sjukdomar, säger Jacob Sten Petersen.