
Mats Gudmundsson och Linda Ihrlund
– Teknologin har utvecklats men vi ligger fortfarande i hög grad kvar i "cytostatikatänket" när det gäller hur vi utvärderar de nya målinriktade läkemedlen. Det säger Mats Gudmundsson, onkolog och medicinsk terapiområdeschef på läkemedels- och diagnostikföretaget Roche. Han är också ordförande i Expertnätverk Cancer inom LIF – de forskande läkemedelsföretagen.
Hans kollega Linda Ihrlund, medicinsk terapiområdeschef på Roche och tidigare bland annat forskare inom experimentell onkologi på Radiumhemmet i Stockholm, förtydligar:

– Klassisk läkemedelsbehandling av cancer består av cytostatika som vanligen är associerade med besvärliga biverkningar för patienten vilket begränsar tiden patienten kan ta emot behandlingen. Om cytostatikan har effekt på tumören ser man på röntgenbilder att tumören krymper. För de nya cancerläkemedlen är bilden mer komplex. På röntgenbilder kan tumören se ut att finnas kvar men samtidigt kan läkemedlet ha god effekt och tumörcellerna vara på väg att dö eller ha förändrats så att de inte längre är skadliga för patienten, säger hon.
Medianöverlevnad ett trubbigt mätverktyg
Andra biologiska förlopp innebär att effekten av nya cancerbehandlingar (målinriktade läkemedel och immunterapier), inte kan utvärderas fullt ut med äldre metoder. Så kallad medianöverlevnad, den tid som gått när hälften av patienterna i en studiegrupp fortfarande är vid liv, fungerar bra i bedömningen av cytostatikas effekter.

– Det är ett bra mått så länge vi bedömer behandling som antingen botar eller inte kan bota patienten. Numera handlar cancerbehandling i hög grad även om att omvandla cancersjukdomar från potentiellt dödliga till kroniska sjukdomar som patienterna kan leva med. Då blir också livskvalitetsmått viktiga och de fångas inte upp av de traditionella mätmetoderna, säger Mats Gudmundsson.
En nackdel med medianöverlevnad är att begreppet inte heller fångar upp skillnader i överlevnad om färre än hälften blir långtidsöverlevare (se resonemang och illustrationer nedan).
De första målinriktade läkemedlen lanserades för knappt femton år sedan och sedan dess har det skett en mycket stark utveckling inom området.
– Det är inte alltid enkelt för behandlande onkologer att veta vilka läkemedel, eller kombinationer, som är bäst för deras patienter. Det finns ett stort behov av studier som klargör på vilka sätt olika behandlingsalternativ kan kombineras eller användas i sekvens för att dra största möjliga nytta av de nya verktygen, menar Linda Ihrlund.
Utveckla regler för prövningar
Reglerna för kliniska prövningar ska självfallet skydda patienterna, men de behöver utvecklas. Det är en omständlig process att förändra reglerna, men en utveckling är på väg inom internationella och nationella läkemedelsmyndigheter.
– Inom EMA, det europeiska läkemedelsverket, testar man former för accelererat godkännande (adaptive licensing) vilket är ett nytt sätt att tänka på hur läkemedel introduceras till patienter. I stället för fas 3-studier med tusentals patienter kan läkemedel få villkorade godkännanden utifrån effektstudier på mindre men väl avgränsade patientgrupper där det finns ett stort behandlingsbehov. Sedan kan användningen stegvist utvidgas till fler patienter när man fått mer kunskap om behandlingen, säger Linda Ihrlund.
Fler företag
Adaptive licensing kan också bidra till en ökad innovationskraft och att vi får fler mindre och medelstora läkemedelsföretag, tror Mats Gudmundsson.
– Det tar i storleksordningen åtta år tills nya läkemedel godkänns med traditionella processer. Med nya arbetssätt kan tiden halveras. Då får även mindre läkemedelsföretag råd att driva hela utvecklingen fram till lansering. Idag är det bara de stora globala företagen som har råd att driva de sista årens utveckling som kostar flera miljarder kronor per läkemedel, säger han.
Titta på "svansen"
Hur ska man då tolka resultaten av de nya läkemedlen? Ett är att titta på "svansen", säger Mats Gudmundsson (se förklarande figurer nedan).
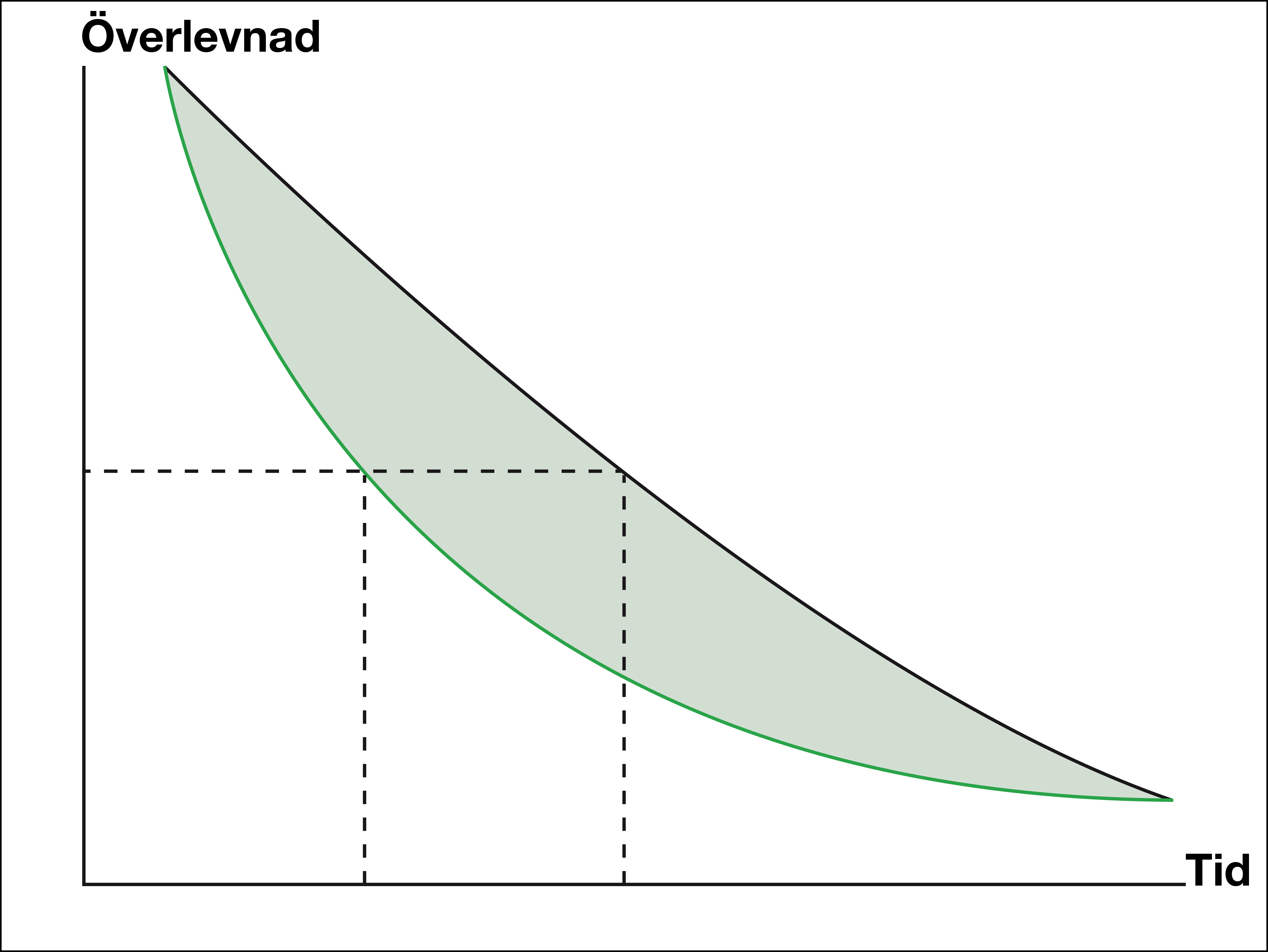
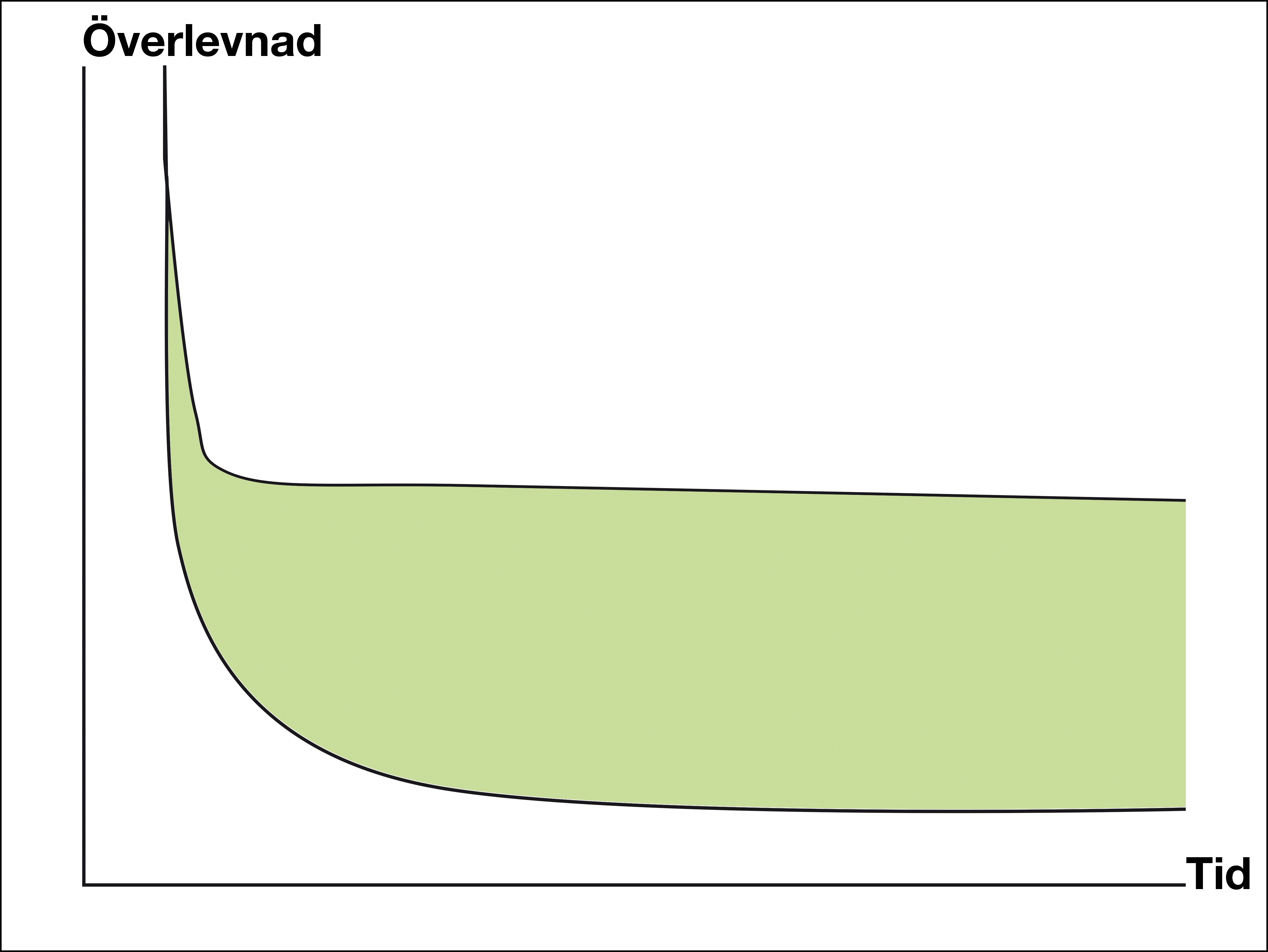
– Traditionella kurvor för cytostatika jämfört med placebo kan visa stora skillnader i överlevnad tidigt under uppföljningstiden. Men överlevnadskurvorna närmar sig varandra senare under uppföljningen. Motsvarande kurvor för de nya läkemedlen kan visa liten effektskillnad inledningsvis, men stora skillnader senare eftersom överlevnadskurvorna planar ut på högre nivåer än för äldre behandlingar, säger han.
I takt med utvecklingen av de nya läkemedlen har man sett kurvan lyftas allt högre och med nya kombinationsbehandlingar har man sett lovande resultat.
– Det är fortfarande väldigt tidiga studier men i några studier man har sett att kurvan har lyfts till 50-60 procent, vilket är enastående. Kan man bekräfta detta i fler studier är det ett enormt framsteg, säger Mats Gudmundsson.
Många markörer kartläggs
Inte bara nya behandlingar påverkar kliniska prövningar. Skräddarsydd behandling och tumördiagnostiken utvecklas starkt och kartlägger numera tumörers hela genuppsättning och inte bara enstaka mutationer. Diagnostiken ger nya möjliga kombinationer av markörer och läkemedel som kan prövas i studier.
Diagnostiken utvecklas också när man tar flera vävnadsprov i olika skeden av sjukdomsförloppet. Tumörernas biologi kan förändras över tid och av behandlingar. Dessutom kan olika delar av primärtumören ha olika egenskaper som kan kräva olika terapier.
Att följa dynamiken i hur markörer förändras genom ett sjukdomsförlopp är komplicerat och mycket hopp sätts till nya metoder där tumörceller eller DNA-fragment från tumörer och metastaser kan analyseras i blod. Det här är ett hett forskningsområde som kan ge möjligheter att följa en patients sjukdom och hur den svarar på behandling med metoder som innebär betydligt mindre besvär för patienten jämfört med dagens biopsier.
– Ny kunskap och nya landvinningar inom en rad områden leder till att effektmått och kliniska prövningar måste anpassas till nya möjligheter, ett behov som erkänns av både företag och myndigheter, säger Linda Ihrlund.

