Under processen behandlas CAR-T-cellerna i flera steg i Novartis anläggning i Morris Plains, New Jersey, USA. Bl.a så förökas, tvättas och fryses de innan transport tillbaka till sjukvården för att återföras till patienten.

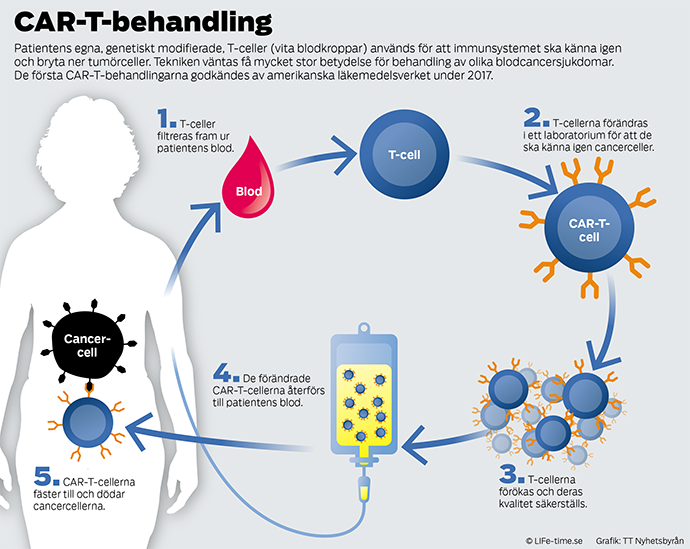
Vårt immunsystem står i centrum för forskning som syftar till att få mer effektiva och skonsamma behandlingar mot cancersjukdomar. Ett område där det pågår mycket forskning är så kallad CAR-T (se faktaruta). Behandlingen är komplex och principen är att man bekämpar en tumörsjukdom med patientens eget immunsystem som fått hjälp och stärkts med teknik utifrån.
Det första godkännandet i världen av en CAR-T-produkt kom den 30 augusti 2017 när den amerikanska läkemedelsmyndigheten FDA godkände läkemedlet Kymriah (CTL019) från företaget Novartis för användning på barn och unga vuxna upp till 25 års ålder som fått återfall i en svår form av leukemi, B-cells-ALL. I en pressrelease från FDA skriver myndigheten att "Vi träder förbi en gräns i den medicinska innovationen med möjlighet att omprogrammera patienters egna celler så att de attackerar en dödlig cancer".

– Det handlar om patienter med mycket stort medicinskt behov. En ansökan för två patientgrupper behandlas för närvarande av den europeiska läkemedelsmyndigheten. Det är dels barn och unga som fått återfall i B-cells-ALL, dels patienter med en form av lymfom, så kallat diffust storcelligt B-cellslymfom, DLBCL, säger Richard Flaaten, nordiskt medicinskt ansvarig för CTL019 på Novartis. Företaget tar sikte på att patienter i Norden som behöver denna behandling ska få tillgång till behandlingen.
Engångsbehandling med lång uppföljning
Behandling med CAR-T ges vid ett tillfälle och patienten följs sedan upp i enlighet med ett särskilt utformat protokoll, ett så kallat REMS, för att upptäcka och behandla eventuella biverkningar.
REMS-programmet innebär en särskild utbildning av vårdpersonal som är involverad i patienten. Företaget kommer att etablera certifierade centrum för behandling och uppföljning.
Ett skäl för ett omfattande uppföljningsprogram är att det kan uppstå svåra biverkningar efter CAR-T-behandling. Patienterna är svårt sjuka, deras immunsystem är svagt och de har tidigare gått genom andra tuffa behandlingar mot sin sjukdom.
CAR-T-behandling kan vara indicerad när annan behandling som cytostatika, strålbehandling, målriktade läkemedel och stamcellstransplantation inte varit tillräckligt för att rädda patientens liv. Femårsöverlevnaden för patienter med B-cells-ALL som genomgått flera behandlingar är lägre än 10 procent.
De första patienterna inom utvecklingsprogrammen för CAR-T behandlades för fem-sex år sedan. I takt med att CAR-T utvecklats längre och man samlat mer data om långtidseffekter kan sannolikt fler patienter behandlas. Det kan vara en fördel att behandla patienter tidigare i sjukdomsförloppet och även mot andra tumörsjukdomar kan metoden vara effektiv.
Helt egen biverkningsprofil
Som nämnts tidigare förknippas CAR-T med svåra biverkningar.
– Det handlar om en helt egen biverkningsprofil. Det är till exempel en reaktion i patientens immunsystem kallad CRS, cytokine release syndrome, och neurologiska biverkningar. En del patienter behöver läggas in akut för behandling av biverkningar. Men vi kan hantera dem, de allra flesta biverkningarna är övergående. I våra studier har vi inte sett dödsfall som beror på biverkningar av behandlingen, säger Richard Flaaten.
När CAR-T-celler-modifieras förs DNA in i cellerna med hjälp av speciella virus. Men man vet inte exakt var i cellernas arvsmassa detta DNA hamnar. Detta kan, åtminstone i teorin, leda till risker.
– Hypotetiskt kan detta DNA påverka andra gener i cellen med effekter vi inte kan förutse. Vi har ännu inte i våra uppföljningar sett något sådant, men på sikt kan sekundär sjuklighet inte uteslutas. Det är ett skäl till att vi kommer följa alla patienter som behandlas med CAR-T i minst 15 år, säger Richard Flaaten.

CAR-T i akademisk forskning
Angelica Loskog, professor i immunterapi vid Uppsala universitet, har forskat kring bland annat CAR-T. Hon startade den första studien med CAR-T utanför USA i samarbete med Baylor College of Medicine i Houston, Texas, där hon tidigare varit verksam.
– Vi samarbetar med Baylor kring kliniska prövningar med det vi kallar tredje generationens CAR. Detta är akademiska prövningar och en första studie med
15 patienter är klar och nu har vi inlett en andra med ytterligare 15 patienter.
Bland annat AFA försäkring, Cancerfonden och Vetenskapsrådet finansierar forskningen. En hög kostnad är produktionen av virus som överför CAR-genen till T-celler, vilket görs på Baylor. Produktionen av de modifierade T-cellerna till varje patient sker hos Vecura (Karolinska universitetssjukhuset) i Novum-området i Huddinge.
Första stegen i Israel
Immunologen Eshhar Zelig var den som i slutet av 1990-talet vid Weizmann-institutet i Tel Aviv, Israel, utvecklade de första CAR-T-cellerna.
– Han forskade kring T-cellers signalering och utvecklade CAR för att studera ett biologiskt fenomen. Först långt senare uppstod tanken att använda dessa receptorer för cancerbehandling. Men den första generationens CAR-T-celler var ingen framgång och överlevde inte i kroppen. Det var först med den andra generationens CAR-T man kunde visa kompletta svar hos patienter och de resultaten publicerades 2011. Sedan dess har all immunterapi formligen exploderat, säger Angelica Loskog.
På sikt kan behandlingen bli att man får en spruta i stället för att man ska ta ut celler från patienten, förändra och odla cellerna i flera veckor.
Patienterna i Angelica Loskogs forskning har lymfom eller leukemi (ALL), men flertalet har lymfom. I den nya studien kommer även barn med ALL att ingå.
Snabb effekt av behandling
Ofta kan det gå lång tid innan effekter av behandling kan mätas. Men CAR-T-terapi skiljer ut sig på den punkten.
– Det som händer inträffar för det mesta efter 3–5 veckor efter att patienten fått CAR-T-cellerna. Uppnås inte en fullständig respons, det vill säga att inga spår efter tumören finns kvar, efter den tiden kommer den sannolikt inte heller att inträffa senare. Av de första 15 patienterna var det sex som fick komplett respons och det är bra eftersom det handlar om svårt sjuka patienter i slutfasen av sin sjukdom. Dock fick de flesta tyvärr återfall i sjukdomen senare, säger hon.
Resultaten var uppmuntrande och därför görs en ny studie med 15 nya patienter. I den första studien gavs endast en dos CAR-T. I den nya kommer en ny dos att ges till patienter som inte visar komplett respons efter den första.
En förhoppning och målet bör vara att CAR-T kan ges som första behandling efter diagnos, men tidiga kliniska prövningar kan bara acceptera patienter som inte svarat på traditionell behandling med bevisad effekt.
– Det är ett bra mål, för CAR-T-celler ger bättre resultat så länge patienten har ett hyfsat fungerande immunförsvar. Dels finns det tillräckligt med T celler att göra CAR-T från patientens blod, men kroppens naturliga T-celler kan också komma att aktiveras och hjälpa till för att öka långtidsöverlevnaden, säger Angelica Loskog.
Hon understryker att forskningen idag i Sverige endast gäller patienter med B-cellsleukemier och lymfom. Men det pågår forskning i USA om att använda CAR-T även mot andra tumörtyper.
Omfattande organisation
Organisationen kring CAR-T-behandling är idag omfattande. Men det är inte osannolikt att det kan bli mycket enklare i framtiden. Redan forskas kring förenklingar.
– Det finns forskning kring metoder där man injicerar ett läkemedel som sedan åstadkommer en genetisk modifiering så att modifierade T-celler skapas i patienterna. Det är bara ett inslag i den snabba utvecklingen. På sikt kan vi förhoppningsvis få se att behandlingen blir som en enkel behandling idag – att man får en spruta i stället för att man ska ta ut celler från patienten, förändra och odla cellerna i flera veckor innan de sprutas tillbaka i patienten, säger Angelica Loskog.
Ett område för utveckling är att hitta sätt att stänga av CAR-T-cellerna efter en viss tid. Det kan göras efter att man slagit ut skadliga celler eller att man utvecklar en funktion för att stänga av och sätta på CAR-T för att bekämpa mikrotumörer som uppstår senare hos patienten.
– Har man ingen mekanism att slå ut CAR-T-cellerna kan de bli långlivade, och det kan leda till ett långvarigt problem med biverkningar. Men redan nu byggs avstängningsmekanismer, genetiska switchar, och med små molekyler kan man starta en process som leder till att CAR-T-cellen dödar sig själv, säger Angelica Loskog.