Mamle Quarmyme, forskare vid Bayers anläggning i San Francisco, USA.

Försöken med genterapi går ända tillbaka till 1990-talet. Så länge har forskare försökt föra in friska gener i celler, med hopp om att kunna bota sjukdomar som beror på genmutationer. Gång på gång har fältet drabbats av bakslag, och tekniken har visat sig svårare att använda än man trott.
Men nu verkar mångårigt arbete bära frukt. Sammantaget har över 2 000 patientstudier gjorts världen över med olika typer av genterapier. Härom året godkändes en terapi mot ärftligt förhöjda blodfetter. Det finns behandling mot vissa immunbrist- och ögonsjukdomar, och kliniska studier pågår kring bland annat blodproppshämmare för patienter med svår njursjukdom. Nyligen kom också positiva besked från en fas III-studie för en genterapi, i form av dropp, för den så kallade Skelleftesjukan. Sjukdomen beror på en mutation som gör att ett visst protein får fel form, vilket ger skador på nerver och muskulatur.

Framtidens industri levererar annat än piller
Det finns i dag ett antal olika tekniker för genterapi (se exempel). Life Science-företaget Bayer arbetar med flera av dem, i projekt som de driver med partners.
– Med genterapi kommer vi att gå från att behandla sjukdomar, till att faktiskt bota dem. Det betyder att industrin måste ha en mycket bredare vision. Jag tror att vi kommer se en utveckling där vi allt mer går från att producera piller, till att leverera annat. Det kan handla om behandlingen som en tjänst, eller övervakning av hälsan, säger Alexander Mata, vetenskaplig rådgivare inom hjärt-kärlsjukdomar hos Bayer.
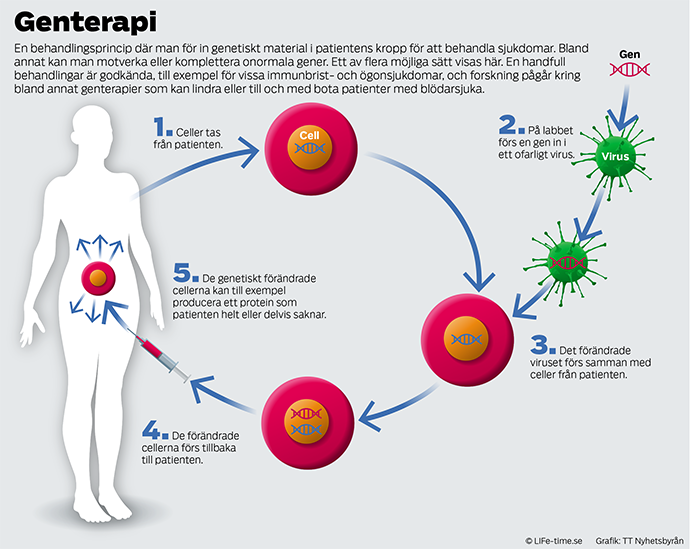
Den äldsta formen av genterapi bygger på att en trasig gen ersätts med en fungerande kopia, som förs in med hjälp av ett ofarligt virus. Numera finns det även teknik för att laga den trasiga genen, och för att föra in molekyler som påverkar produktionen av protein från en trasig gen. Men oavsett hur man gör så fungerar genterapi bara på sjukdomar som utlöses av en enda gen, eller ett fåtal.
Med genterapi kommer vi att gå från att behandla sjukdomar, till att faktiskt bota dem.
– Mer komplexa sjukdomar som beror av många gener är vi inte ens nära att lösa än. Men det finns mycket att göra kring de monogena sjukdomarna, säger Alexander Mata.
Han konstaterar att det fortfarande finns flera utmaningar. Genen måste föras in med tillräcklig precision, så att den inte hamnar någonstans där den blir overksam eller påverkar andra geners verksamhet. Och när den väl hamnat på rätt plats, är nästa fråga hur länge de behandlade cellerna lever.
– Om det till exempel handlar om en celltyp som byts ut relativt fort, så skulle vi behöva upprepa behandlingen, säger Alexander Mata.
Liten förbättring stor skillnad för blödarsjuka
En allvarlig blodsjukdom ligger just nu nära till hands för behandling med genteknik. Flera företag driver studier med inriktning mot hemofili, ofta kallat blödarsjuka. Hemofili beror på genmutationer som gör att kroppen saknar förmåga att producera koagulationsfaktorer, proteiner som gör så att blodet tjocknar vid skador. Resultatet kan bli svåra och smärtsamma inre blödningar, och stor blodförlust vid skador.
Johan Richter, överläkare vid avdelningen för molekylärmedicin och genterapi vid Lunds universitet, konstaterar att hemofili lämpar sig väl för genterapi. Sjukdomen beror på förändringar i enstaka eller ett fåtal gener, patientgruppen är relativt stor, och symtomen är allvarliga.
– De som är svårast sjuka behöver få injektioner med koagulationsfaktorer flera gånger i veckan. Det har verkligen funnits ett behov av att hitta en mer permanent lösning för dem, och nu går området hemofili väldigt snabbt framåt, säger Johan Richter.
Steg för steg har forskningen löst problem på vägen. Det har bland annat handlat om att välja en lämplig virustyp för att föra in generna, och att hitta ett sätt att hindra immunreaktioner som kan slå ut de förändrade cellerna. Hos blödarsjuka är det inte nödvändigt att uppnå någon fullständig bot. En person som bara producerar 1 procent av den normala mängden koagulationsfaktor, kan behandlas så att den producerar 10 procent av det normala.
Kanske kan man tänka sig en avbetalningsmodell, där vården betalar till företaget varje år som patienten mår bra.
– Det räcker att lyfta de här patienterna en liten bit, så har du dramatiskt förbättrat deras livskvalitet, säger Johan Richter.
Han har följt genterapins utveckling under flera decennier och sett både framgångarna och bakslagen.
– Under första halvan av 1990-talet lyckades man få in genetiskt material i odlade celler, och i djur. Då väcktes hoppet om att kunna åstadkomma en livslång genetisk förändring hos patienter. Tyvärr visade det sig vara för optimistiskt.
En bestående förändring kräver att de friska generna förs in i stamceller, som har förmåga att fortsätta producera nya celler under lång tid. Men för tjugofem år sedan fanns inga bra experimentella system för att testa stamceller, så försöken hade gjorts på mer mogna celler. Det visade sig vara mycket svårare att få tekniken att fungera i stamceller.
– När patienter fick infusioner med genförändrade blodceller, så levde cellerna bara några veckor, eller i bästa fall månader. Virusen som användes för införandet var inte tillräckligt effektiva, och generna trängde inte in i de celler som krävdes, säger Johan Richter.
Med tiden hittade forskare mer effektiva virustyper. Omkring millennieskiftet behandlades flera barn med svår immunbristsjukdom med genförändrade stamceller, och tillfrisknade tack vare att de förändrade stamcellerna levde kvar i kroppen och fortsatte producera friska celler. Men efter några år kom nästa bakslag: en del av barnen fick leukemi, blodcancer.
Även om mycket fortfarande är oklart kring de mekanismer som gjorde att terapierna ledde till cancersjukdom, så fann forskarna sätt att kontrollera risken. 2016 godkändes för första gången i Europa en genterapeutisk behandling just för en svår immunbristsjukdom. Vid den utvinns celler ur patientens kropp och får en frisk gen införd med hjälp av ett så kallat gammaretrovirus.
Johan Richter konstaterar att framtidens tekniker kommer att vara betydligt mer exakta än både dagens och gårdagens.
– Att ersätta en trasig gen med en fungerande som förs in på en slumpmässig plats... Någon sa att det är som att ha en bil med fel på tändstiftet och fixa det genom att sätta en ny motor i baksätet. De helt nya teknikerna, CRISPR/Cas9 och liknande, har i de flesta fall inte kommit tillräckligt långt ännu för att användas i patienter. Men med dem ändrar man verkligen i generna – det blir mer som att faktiskt byta tändstiftet.
När forskningen lyckats, återstår andra utmaningar
Att genterapier till sist är på väg att få sitt genombrott påverkar inte bara patienterna. Vårdgivare, myndigheter, läkemedelsföretag och betalare står i en helt ny situation.
– Var utmaningarna ligger? Överallt!
De här terapierna kan bli en total gamechanger för medicinen. Men dagens lagstiftning ligger efter.
Det säger Kristina Kannisto, forskare inom regenerativ medicin vid Karolinska Institutet. Hon är på deltid projektledare för Konkurrenskraft cell- och genterapi, som drivs av innovationsprogrammet Swelife, finansierat av myndigheten Vinnova. Projektet ska samla och sprida kunskap som svenska företag, myndigheter och organisationer behöver för att kunna arbeta med cell- och genterapier.
– De här terapierna kan bli en total game changer för medicinen. Men dagens lagstiftning ligger efter och behöver anpassas, säger Kristina Kannisto.
Nära samarbeten mellan företag och vård
Hon konstaterar också att varken sjukvården eller företagen kan arbeta på egen hand i utvecklingen. Företagen kan inte ta fram cell- och genterapier utan ett nära samarbete med sjukvården, eftersom materialet till behandlingen ofta kommer antingen från patienten själv, eller från donatorer i vården. Men sjukvården, å sin sida, har inte kapacitet att utveckla marknadsgodkända läkemedel.
Alexander Mata på Bayer håller med om att det kommer att krävas både nya affärsmodeller och nya arbetssätt.
– Till en början tror jag inte att behandlingarna kommer att kunna göras på vanliga sjukhus. Man kan tänka sig något slags excellence centers runtom i landet, dit patienterna kommer för att behandlas – den typen av service skulle kunna erbjudas av företag. Kanske kan vi driva centren själva, eller tillsammans med en lokal partner eller med sjukhus i regionen. Definitivt får vi se fler nära samarbeten i framtiden. På sikt kommer behandlingarna flytta in i sjukhusen, säger Alexander Mata.
Men han ser för sig att företagen även då kan behöva vara på plats, på samma sätt som medicinteknikföretag ibland har företrädare med under en operation för att sköta eller ge råd om utrustningen.
– Vi behöver erbjuda mer och annat än bara en behandling. Troligen kommer många genterapier behöva upprepas, eftersom de förändrade cellerna bara överlever en viss tid, säger Alexander Mata.
Betalning anpassad efter en ny sorts behandling
Kostnaden är en annan stor utmaning. En livslång behandling som kanske utförs varje vecka eller ännu oftare, kan potentiellt bytas mot en som utförs ett fåtal gånger. Hur mycket kan företagen ta betalt? Om den som utvecklat behandlingen vill ha ersättning som motsvarar kostanden för ett livs behandling – hur ska vårdens budgetsystem klara det?
Johan Richter vid Lunds universitet konstaterar att det behövs nya ersättningssystem.
– Kanske kan man tänka sig något slags avbetalningsmodeller, där patienten kommer på regelbundna kontroller och så får vården betala till företaget under varje år som patienten mår bra. För i vården är vi väldigt fixerade vid våra årliga läkemedelsbudgetar. Man kan också tänka sig att om terapin inte ger de tänkta resultaten, så är det "payback time" för bolagen. Som ett slags garanti, säger Johan Richter.
Alexander Mata pekar på möjligheten med offentlig-privat samverkan, där risk och vinst delas mellan företag och stat eller region.

Men han ser också för sig liknande scenarion som de Johan Richter beskriver.
– Det här ser vi redan inom vissa behandlingar, att olika patienter svarar olika bra och att ersättningen anpassas efter det. Sjukvården betalar för framgång. Och egentligen, varför inte? Så är det ju med andra produkter, om de inte fungerar har man rätt att reklamera dem. Men hur mycket behandlingen är värd är en intressant diskussion. Kanske kommer man att vilja ta hänsyn till hur gammal patienten är, hur många arbetsföra år den har kvar... Det är svåra frågor, också rent etiskt. De här behandlingarna blir dyra. I slutänden återstår det att se vilka patienter som alls får tillgång till dem.